LE PIOGGE ACIDE
LE PIOGGE ACIDE |
DESCRIZIONE DEL FENOMENO
Il fenomeno delle piogge acide è dovuto a
trasformazioni chimiche subite dagli inquinanti atmosferici. Innanzi tutto è importante
specificare che una pioggia viene definita acida quando il suo pH è minore di 5: infatti
in condizioni normali di concentrazione di CO2 e pressione si viene a creare
una soluzione tampone di H2CO3/HCO3-
a pH 5,6 (CO2 + H2O = H++
HCO3-).
Prima di parlare delle alterazioni chimico-fisiche subite dai gas presenti in
atmosfera, è interessante conoscere la sua struttura e la sua composizione. La
Terra è infatti circondata da 2000 Km di massa aeriforme non omogenea divisa per
convenzione in 5 zone che si caratterizzano per altezza dal suolo, gradiente termico e
proprietà chimico-fisiche diverse.
STRUTTURA dell'ATMOSFERA TROPOSFERA (da 7 Km
a 12 Km ): zona di formazione di tutti i fenomeni meteorologici, fra i quali le piogge
acide |
 |
 |
MECCANISMO
DI ACIDIFICAZIONE
Gli ossidi
d’azoto e di zolfo sono i principali responsabili dell’acidità delle piogge.
Questi vengono prodotti nei processi di combustione ad alte temperature e, per questo,
sono i principali inquinanti prodotti dai mezzi di trasporto e dai processi di combustione
industriali. La pioggia diventa acida quando le reazioni che coinvolgono questi
composti li trasformano in acido nitrico e acido solforico:
- SO3 + H2O => H2SO4
- NO2+ H2O => HNO3
Azione degli ossidi di zolfo
La quantità di SO2 sviluppata dai processi inquinanti reagisce
nell’atmosfera con piccolissime particelle metalliche le quali catalizzano, con il
contributo delle radiazioni luminose, la reazione: 2SO2
+ O2 + MeO + hv => 2SO3 + MeO . Questi
particolari ossidi metallici sono costituiti principalmente da manganese, ferro, e
vanadio; ossidandosi all’aria riescono a rigenerare la reazione di formazione del
triossido di zolfo con un meccanismo analogo per tutti i metalli: SO2 + V2O5=> SO3
+2VO2 ; ( 2VO2+O2
=> V2O5 ). L’anidride solforosa
così generata a contatto con l’acqua genera acido solforico: SO3
+ H2O => H2SO4 . Solitamente,
comunque, una parte di queste reazioni di ossidazione è regolata da radicali prodotti da
meccanismi fotochimici quali: ioni ossidrili, perossidrili, perossidi etc. responsabili
degli intermedi di reazione (vedi TABELLA).
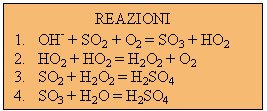 Nella reazione (1) una parte di anidride solforosa reagendo con lo
ione ossidrile, si trasforma in anidride solforica, la quale idrolizzata produrrà acido
solforico (4). Sempre nella (1) si produce anche lo ione perossidrile il quale reagirà
formando perossido di idrogeno (2) responsabile della 3. Come si può notare, analizzando
le reazioni precedenti, tutti i percorsi convergono alla formazione di acido solforico il
quale solubilizzandosi nel vapore acqueo, precipita con esso nelle piogge, conferendogli
un pH molto acido (variabile a seconda delle concentrazioni ma comunque inferiore a 4,5).
Questo vapore acqueo "inquinato" può essere trasportato dai venti anche
molto lontano dal sito dove si forma, e questo ci fa capire la dimensione del problema,
nato con la rivoluzione industriale e destinato ad aggravarsi sempre più se non verranno
posti dei limiti sulle emissioni nocive. Abbiamo qui alcuni dati raccolti nel periodo
primaverile 1999, riferiti alle deposizioni piovose a Firenze e Vallombrosa nelle quali si
può notare questa correlazione (sostanza in esame SO42-):
Nella reazione (1) una parte di anidride solforosa reagendo con lo
ione ossidrile, si trasforma in anidride solforica, la quale idrolizzata produrrà acido
solforico (4). Sempre nella (1) si produce anche lo ione perossidrile il quale reagirà
formando perossido di idrogeno (2) responsabile della 3. Come si può notare, analizzando
le reazioni precedenti, tutti i percorsi convergono alla formazione di acido solforico il
quale solubilizzandosi nel vapore acqueo, precipita con esso nelle piogge, conferendogli
un pH molto acido (variabile a seconda delle concentrazioni ma comunque inferiore a 4,5).
Questo vapore acqueo "inquinato" può essere trasportato dai venti anche
molto lontano dal sito dove si forma, e questo ci fa capire la dimensione del problema,
nato con la rivoluzione industriale e destinato ad aggravarsi sempre più se non verranno
posti dei limiti sulle emissioni nocive. Abbiamo qui alcuni dati raccolti nel periodo
primaverile 1999, riferiti alle deposizioni piovose a Firenze e Vallombrosa nelle quali si
può notare questa correlazione (sostanza in esame SO42-):
| conc. SO42- (ppm) | PRELIEVO |
PRELIEVO |
PRELIEVO |
PRELIEVO |
| FIRENZE | 2,42 |
0,98 |
Non rilev. |
1,25 |
| VALLOMBROSA | 1,34 |
1,34 |
0,77 |
0,48 |
Azione degli ossidi di azoto
Gli inquinanti principali, grazie al quale si accentua questo fenomeno delle piogge
acide, sono l’ossido di azoto NO e il biossido di azoto NO2. Generalmente
questi composti vengono classificati con il termine generico di NOx. Questi
ossidi vengono prodotti nei processi di combustione ad alta temperatura secondo le
equazioni (1) (2) (3) della TABELLA a fianco.
Queste sostanze, sprigionate nell’atmosfera, a contatto con il vapore acqueo
formano acido nitrico, dopo successive trasformazioni (4) (5) (6).
EFFETTI DELLE PIOGGE ACIDE
Gli ossidi di zolfo, insieme agli ossidi d’azoto, sono i principali componenti delle piogge acide. Gli effetti di questa piogge sono molteplici e interessano la vegetazione, gli ecosistemi idrici, le opere murarie .
Effetti sui materiali
 L’acido solforico delle piogge acide
reagisce con il CALCARE delle pietre secondo la reazione:
L’acido solforico delle piogge acide
reagisce con il CALCARE delle pietre secondo la reazione:
H2SO4 + CaCO3 => CaSO4
+ H2O + CO2 .
Questa reazione avviene in presenza di catalizzatori come la polvere, il carbone,
ossidi di vanadio o di ferro che sono spesso presenti nelle croste delle pietre e nello
smog . Come si può vedere dalla reazione i calcari vengono trasformati in solfati, cioè
in gesso, che è un prodotto solubile . Anche l’attacco dell’anidride solforosa
al calcare si risolve nella solubilizzazione del calcio .
Questo fenomeno è ben visibile in quanto le scaglie giallastre si distaccano dalle
superfici lapidee al cui interno si rivelano ampi crateri . Questo accade quando aumenta
il volume del gesso bagnato . Un successivo esame al microscopio elettronico rivela
l’attacco intergranulare che si dirama all’interno della pietra e che prosegue
quindi in modo invisibile . Anche sul BRONZO
l’inquinamento degli ossidi di zolfo ha gravi conseguenze . Mentre
dall’antichità fino ad oggi i bronzi si sono andati ricoprendo di una patina
protettiva di carbonati basici, forme mineralogiche normali tra i prodotti di corrosione
del rame in atmosfera non inquinata, oggi essi vengono man mano ricoprendosi di una patina
di solfati, che è riconoscibile perché è assai più chiara di quella dovuta ai
carbonati . L’acido solforico delle piogge acide e del vapore acqueo che condensa sui
bronzi all’aperto, reagisce con gli ossidi e i sali prodotti dalla corrosione del
rame ( carbonati, cloruri e solfati basici ), trasformandoli gradualmente in composti via
via più solubili, attraverso le ripetute condensazioni ed evaporazioni dell’acqua
dalle superfici di bronzo, che vengono quindi portati in soluzione .
![]() Un altro
materiale su cui agisce l’acido solforico è il CEMENTO ARMATO
. Il cemento armato è formato da un sale costituito da una base forte, la calce, e un
acido debole, l’acido silicico . L’acido solforico tende a combinarsi con la
parte basica del cemento armato, proprio perché è legata ad un acido debole . Avviene
così una reazione di solfatazione che porta alla degradazione del cemento armato . Anche
i LATERIZI sono attaccati dall’SO2
dell’aria che può condurre alla formazione di solfati che attaccano i mattoni e le
malte . Questi solfati reagiscono con la MALTA di cemento, in
particolare con l’alluminato tricalcico, con la conseguente formazione di
solfoalluminato di calcio accompagnata da aumento di volume che provoca la dilatazione e
la disgregazione della malta: la dilatazione in senso verticale dei singoli giunti di
malta può causare un notevole movimento di tutta la muratura di mattoni; la parte
superiore di una muratura che è gravata da carichi minori tende infatti a dilatarsi di
più della parte inferiore .
Un altro
materiale su cui agisce l’acido solforico è il CEMENTO ARMATO
. Il cemento armato è formato da un sale costituito da una base forte, la calce, e un
acido debole, l’acido silicico . L’acido solforico tende a combinarsi con la
parte basica del cemento armato, proprio perché è legata ad un acido debole . Avviene
così una reazione di solfatazione che porta alla degradazione del cemento armato . Anche
i LATERIZI sono attaccati dall’SO2
dell’aria che può condurre alla formazione di solfati che attaccano i mattoni e le
malte . Questi solfati reagiscono con la MALTA di cemento, in
particolare con l’alluminato tricalcico, con la conseguente formazione di
solfoalluminato di calcio accompagnata da aumento di volume che provoca la dilatazione e
la disgregazione della malta: la dilatazione in senso verticale dei singoli giunti di
malta può causare un notevole movimento di tutta la muratura di mattoni; la parte
superiore di una muratura che è gravata da carichi minori tende infatti a dilatarsi di
più della parte inferiore .
 L’acido
solforico attacca anche il FERRO secondo le reazioni:
L’acido
solforico attacca anche il FERRO secondo le reazioni:
a) Fe + H2SO4 + O2 =>
FeSO4 + H2O
b) FeSO4
+ O2 + H2O = FeO (OH) + H2SO4
Si tratta di una degradazione del ferro a ciclo continuo, se il tasso di anidride
solforica rimane elevato, che conduce all’attacco sempre più profondo delle
membrature metalliche . L’anidride solforosa favorisce comunque la corrosione dei
metalli in generale, aumentandone la velocità del processo di corrosione .
Gli ioni dell'acido nitrico possono corrodere strutture metalliche ma anche
murature in mattoni, perché in grado di solubilizzare il calcio e precipitare come
nitrati; aumentando di volume sgretolano il manufatto.
 Effetti
sulla vegetazione
Effetti
sulla vegetazione
Per l’elevato rapporto superficie/volume e per essere sede degli scambi
gassosi, le FOGLIE sono gli organi delle piante più esposti
e vulnerabili agli inquinanti atmosferici . Questi vi penetrano attraverso gli stomi
sciogliendosi nei veli liquidi intercellulari che permeano le pareti delle cellule del
mesofillo . Il loro aumento di concentrazione nella fase liquida ne facilita poi la
diffusione nelle cellule e la corrente traspiratoria ne regola il trasporto e, in alcuni
casi, l’accumulo in parti diverse della foglia . Perciò sono proprio le foglie che
subiscono nel modo più vistoso gli effetti degli inquinanti dell’aria e delle piogge
acide .
L’SO2 provoca danni valutabili in termini di superficie fogliare
necrotica ( SO2 viene trasformata in H2SO4 ) o
alterazioni di forma e colore delle foglie ( interferisce con la formazione e il
funzionamento della clorofilla ) . Un esposizione prolungata a concentrazioni di anidride
solforosa incapaci di causare sintomi evidenti, possono produrre alterazioni fisiologiche
come la riduzione della crescita e della produzione e la senescenza anticipata .
L’effetto sulle PIANTE è particolarmente
accentuato quando l’anidride solforosa si trova in presenza di ozono . Questo
fenomeno è detto sinergismo ed ha effetto maggiore della somma degli effetti delle
sostanze prese separatamente .
 Le piogge acide e l’ozono potrebbero
contribuire a creare una condizione di scarsità di apporti nutritivi in una conifera, e
hanno un importante ruolo nel declino delle foreste . L’ozono agisce sia distruggendo
la clorofilla, sia degradando il rivestimento ceroso degli aghi . Le piogge acide o le
goccioline ancora più acide delle nubi possono allora penetrare più facilmente nel
tessuto degli aghi lisciviando le sostanze nutritive in esso contenute . Nel SUOLO gli acidi potrebbero aggravare la carenza di sostanze
nutritive mobilizzando l’alluminio, che è in grado di spostare il calcio dai suoi
siti di legame sui peli radicali . Sottoposto al trauma di un apporto troppo scarso di
sostanze nutritive, l’albero è facilmente attaccato da insetti, malattie e altri
agenti .Perciò anche in zone dove l’inquinamento atmosferico è basso, le piogge
acide agiscono più come fattori traumatici che come agenti letali, dopo che la pianta è
già stata indebolita da un inverno rigido, da suoli poco profondi o da venti secchi, che
si incontrano nelle foreste di montagna .
Le piogge acide e l’ozono potrebbero
contribuire a creare una condizione di scarsità di apporti nutritivi in una conifera, e
hanno un importante ruolo nel declino delle foreste . L’ozono agisce sia distruggendo
la clorofilla, sia degradando il rivestimento ceroso degli aghi . Le piogge acide o le
goccioline ancora più acide delle nubi possono allora penetrare più facilmente nel
tessuto degli aghi lisciviando le sostanze nutritive in esso contenute . Nel SUOLO gli acidi potrebbero aggravare la carenza di sostanze
nutritive mobilizzando l’alluminio, che è in grado di spostare il calcio dai suoi
siti di legame sui peli radicali . Sottoposto al trauma di un apporto troppo scarso di
sostanze nutritive, l’albero è facilmente attaccato da insetti, malattie e altri
agenti .Perciò anche in zone dove l’inquinamento atmosferico è basso, le piogge
acide agiscono più come fattori traumatici che come agenti letali, dopo che la pianta è
già stata indebolita da un inverno rigido, da suoli poco profondi o da venti secchi, che
si incontrano nelle foreste di montagna .
Effetti sugli ecosistemi
Nella zona di caduta delle piogge acide ha inizio una serie di mutamenti fisici
e chimici, che può ridurre l’acidità e modificare le caratteristiche chimiche
dell’acqua che infine raggiunge laghi e fiumi . I SUOLI,
come quelli contenenti rocce calcaree, possono neutralizzare direttamente l’acidità
. Nei suoli leggermente acidi tipici delle foreste di conifere degli Stati Uniti, del
Canada e dell’Europa, altri due processi possono modificare gli effetti delle
deposizioni acide . L’acidità può essere "immobilizzata" quando il suolo
o la vegetazione trattengono ioni solfato, oppure può essere "tamponata"
tramite lo scambio di ioni positivi . In quest’ultimo processo gli ioni calcio,
magnesio e di altri metalli che si trovano in diversi suoli prendono il posto degli H+
nell’acido, che rimangono in loco . Gli ioni metallici vengono prodotti dalla
disgregazione delle rocce . L’entità della ritenzione nel suolo e dello scambio di
cationi nelle acque superficiali o sotterranee dipende dalle caratteristiche del bacino
idrico, in particolare dalla geologia, dalla vegetazione e dall’andamento del flusso
. I processi che avvengono nel suolo non possono avere effetti nelle acque che scorrono su
terreni gelati o su un basamento di granito e perciò l’acqua che raggiunge un lago o
un torrente in questi casi rimane acida quanto quella piovana .
Anche quando l’acqua riesce a infiltrarsi in profondità i processi in
questione possono risultare inefficaci . Il quarzo, per esempio, è resistente alla
disgregazione ed è privo di ioni metallici necessari per lo scambio di cationi; di
conseguenza la percolazione attraverso sabbia quarzosa contribuisce ben poco a ridurre
l’acidità. Tuttavia in un bacino idrico avente un suolo profondo in grado di
contenere grandi quantità di solfati, o ricco di cationi facilmente scambiabili, il
trasferimento di acidità in un lago o in un fiume può essere rimandato, almeno fino a
quando la capacità di ritenzione o di effetto tampone non siano esaurite .
Un LAGO che presenta una capacità di neutralizzazione
elevata è almeno momentaneamente protetto dagli effetti delle piogge acide; al contrario,
un lago avente capacità di neutralizzazione nulla può rimanere sano solo se non è
esposto a precipitazioni acide, altrimenti viene acidificato immediatamente .Queste
acidificazioni comportano gravi interazioni nei laghi abbassandone il pH . Consistenti
acidificazioni dei laghi si sono avute in Scandinavia, negli Stati Uniti nordorientali e
nel Canada sudorientale . Questo abbassamento del pH comporta grossi problemi alle
popolazioni ittiche, come la riduzione delle dimensioni e la diversità delle varie specie
. Inoltre lo sviluppo di embrioni di alcuni pesci viene bloccato già a valori di pH
minori di 6, mentre, a valori inferiori a 5, cominciano a scomparire alcune specie, prime
fra tutte i salmoni e le trote . L’acidità dei laghi può inoltre modificare le
popolazioni di diatomee e di alghe brune che essi ospitano
.