SMOG FOTOCHIMICO
SMOG FOTOCHIMICO |
DESCRIZIONE DEL FENOMENO
 Cinque sostanze danno conto di circa il
98% dell’inquinamento atmosferico. Sono ossido di carbonio, gli ossidi di zolfo, gli
idrocarburi, sostanze allo stato di particelle e gli ossidi di azoto; tra questi, gli
ossidi di zolfo, incidono per circa il 18%. Spesso si fa distinzione tra due tipi di
inquinamento. Il primo è caratterizzato dalla presenza dell’anidride solforosa (
caso di nostro interesse) e di fumo della combustione incompleta del carbone e da
condizioni atmosferiche di nebbia e freddo. In ragione della sua natura chimica, questa
situazione prende il nome di " tipo riducente di inquinamento". Il secondo è
caratterizzato dalla presenza di idrocarburi, ossidi di azoto e ossidanti fotochimici;
proviene dai gas di scarico delle automobili e si presenta soprattutto in aree dove la
luce solare intensa innesca reazioni fotochimiche nelle masse di aria inquinata che
vengono intrappolate dallo strato di inversione termica (nella FOTO, presa dal CD Prov.Fi
'99). In ragione della sua natura, questa situazione è denominata 2° tipo ossidante di
inquinamento o inquinamento atmosferico fotochimico. Episodi acuti di inquinamento
atmosferico elevato possono rendersi responsabili di decessi e malattie. Ad ammalarsi e
morire, in genere, sono soprattutto gli anziani, soprattutto se questi sono affetti da
disturbi cardiaci o respiratori o da entrambi i tipi. Nel 1952 a Londra si
verificarono 4 giornate di smog eccezionale: per le sue conseguenze morirono circa 4000
persone.
Cinque sostanze danno conto di circa il
98% dell’inquinamento atmosferico. Sono ossido di carbonio, gli ossidi di zolfo, gli
idrocarburi, sostanze allo stato di particelle e gli ossidi di azoto; tra questi, gli
ossidi di zolfo, incidono per circa il 18%. Spesso si fa distinzione tra due tipi di
inquinamento. Il primo è caratterizzato dalla presenza dell’anidride solforosa (
caso di nostro interesse) e di fumo della combustione incompleta del carbone e da
condizioni atmosferiche di nebbia e freddo. In ragione della sua natura chimica, questa
situazione prende il nome di " tipo riducente di inquinamento". Il secondo è
caratterizzato dalla presenza di idrocarburi, ossidi di azoto e ossidanti fotochimici;
proviene dai gas di scarico delle automobili e si presenta soprattutto in aree dove la
luce solare intensa innesca reazioni fotochimiche nelle masse di aria inquinata che
vengono intrappolate dallo strato di inversione termica (nella FOTO, presa dal CD Prov.Fi
'99). In ragione della sua natura, questa situazione è denominata 2° tipo ossidante di
inquinamento o inquinamento atmosferico fotochimico. Episodi acuti di inquinamento
atmosferico elevato possono rendersi responsabili di decessi e malattie. Ad ammalarsi e
morire, in genere, sono soprattutto gli anziani, soprattutto se questi sono affetti da
disturbi cardiaci o respiratori o da entrambi i tipi. Nel 1952 a Londra si
verificarono 4 giornate di smog eccezionale: per le sue conseguenze morirono circa 4000
persone.
Si può dire che l’inquinamento atmosferico di tipo riducente comporta danni alla
salute che si manifestano nel breve termine. Sembra invece meno certo il nesso tra
l’inquinamento di tipo ossidante fotochimico e episodi acuti di compromissione della
salute; si sono riscontrate tuttavia correlazioni statisticamente significative tra
concentrazioni di ossidanti nell’aria e ricoveri ospedalieri per manifestazioni
allergiche, infiammazioni a carico degli occhi, infezioni delle vie aeree superiori,
influenza e bronchiti.
Gran parte dei processi inquinanti che si sviluppano nell’atmosfera sono da
attribuire alla interazione delle radiazioni elettromagnetiche (sotto forma di fotoni) con
le molecole. Non sempre però questo tipo di interazione riesce a sviluppare fenomeni
inquinanti, ciò avviene quando si vengono a creare condizioni particolari. Infatti solo
le molecole che assorbono la radiazione di una particolare frequenza subiscono una
reazione: l’entità di questa reazione è direttamente proporzionale al prodotto
dell’intensità luminosa per il tempo di irraggiamento.
Questi processi fotochimici avvengono perché l’assorbimento di un fotone produce
un’eccitazione della molecola, ossia una transizione a stati corrispondenti di
livelli energetici superiori, cui corrisponde una maggiore reattività chimica . Tutto
ciò permette a molecole chimicamente inerti di reagire o di accelerare processi che in
condizioni normali si svolgerebbero lentamente. Rispetto alle reazioni termiche, quelle
fotochimiche presentano il vantaggio della selettività: a una determinata frequenza della
radiazione corrisponde una specifica reazione di una sostanza chimica. E’ però
importante ricordare che la maggior parte delle sostanze chimiche non reagisce
fotochimicamente perché la durata media dell’eccitazione delle molecole non è
sufficientemente lunga da permettere la reazione; cosicché la molecola perde
l’energia ceduta dalla radiazione, prima che la sua trasformazione abbia luogo.
MECCANISMO DELLE FOTOOSSIDAZIONI
 Come
specificato i fenomeni chimici nell’atmosfera sono strettamente correlati con la
fotochimica. I composti volatili che entrano in troposfera da fonti geologiche ,
antropiche e biologiche contengono elementi in forma ridotta rispetto agli stati di
ossidazione termodinamicamente favoriti, ed è per questo che avvengono reazioni spontanee
di ossidazione. Nell’atmosfera terrestre esistono infatti tantissime sostanze
ossidanti; la più abbondante è senza dubbio l’ozono O3 seguito da
sostanze in piccola concentrazione, ma più reattive, come i radicali OH e HO2,
come l’ossigeno atomico O e l’ossigeno molecolare O2; di notte è
attivo anche il radicale NO3.
Come
specificato i fenomeni chimici nell’atmosfera sono strettamente correlati con la
fotochimica. I composti volatili che entrano in troposfera da fonti geologiche ,
antropiche e biologiche contengono elementi in forma ridotta rispetto agli stati di
ossidazione termodinamicamente favoriti, ed è per questo che avvengono reazioni spontanee
di ossidazione. Nell’atmosfera terrestre esistono infatti tantissime sostanze
ossidanti; la più abbondante è senza dubbio l’ozono O3 seguito da
sostanze in piccola concentrazione, ma più reattive, come i radicali OH e HO2,
come l’ossigeno atomico O e l’ossigeno molecolare O2; di notte è
attivo anche il radicale NO3.
Ora, poiché le radiazioni solari, nello scendere verso terra, perdono via via, strada
facendo, le componenti a più alta energia, è evidente che i processi di fotolisi e
fotodissociazione, cui esse danno luogo, saranno in funzione della quota. Così ad
esempio, il protossido di azoto N2O si fotolizzerà ad azoto molecolare e
ossigeno atomico soltanto ad alta quota, in stratosfera, perché sono necessarie
radiazioni di lambda inferiore a 180 nm. Nei processi fotodissociativi si rompe un legame
della molecola, e perciò la grandezza determinante è l’energia di legame; allora,
se il fotone incidente possiede una energia maggiore di quella necessaria, può succedere
che i frammenti vadano in uno stato elettronicamente eccitato. Per quanto riguarda i
grandi fenomeni atmosferici, le radiazioni luminose entrano nell’atmosfera e generano
fotoradicali, i quali interagiscono con il sistema NOx –CV(composti
volatili)- ARIA, innescando processi che portano a uno smaltimento di questi composti a
prodotti finali semplici; questi processi portano, oltre agli effetti positivi già
citati, anche anomalie come fotosmog e accumulo di ossidanti, specialmente nei mesi caldi,
aumento dell’ozono e deposizioni acide.
Grande importanza ha l’ozono in tutti i processi fotochimici; esso è infatti
l’indicatore della presenza di tali reazioni, essendo talvolta prodotto e talvolta
distrutto. Tali equilibri sono però influenzati anche dalla presenza di CFC, CH4,
e N2O. Il principale ossidante troposferico, rimane comunque il radicale OH.
Spesso questo ciclo di reazioni che servono come detto a smaltire i prodotti inquinanti,
possono avvenire o troppo velocemente o troppo lentamente:
a)Troppo veloce: i tempi di residenza atmosferica sono brevi; si ha una rapida
degradazione e smaltimento degli inquinanti ma si avranno elevate concentrazioni di
ossidanti prodotti e di fotosmog.
b)Troppo lento: oltre all’effetto di lunghi periodi di residenza in troposfera degli
inquinanti, andrà considerato il pericolo che essi abbiano il tempo di diffondersi in
stratosfera creando fenomeni di polluzione.
 Alle quote più basse lo smog fotochimico è costituito da una
serie di reazioni che coinvolgono il biossido di azoto: questo insieme di 3 stadi di
reazione costituisce un ciclo chiuso poiché ogni specie viene consumata e successivamente
prodotta, e pertanto il danno è minimo.
Alle quote più basse lo smog fotochimico è costituito da una
serie di reazioni che coinvolgono il biossido di azoto: questo insieme di 3 stadi di
reazione costituisce un ciclo chiuso poiché ogni specie viene consumata e successivamente
prodotta, e pertanto il danno è minimo.
Ma il ciclo viene aperto dalla presenza di idrocarburi e derivati e così si avvia la
formazione dei fotossidanti ( fotosmog) che mostra l’accumulo di particolari prodotti
in funzione dell’ora del giorno; questa produzione particolare è dovuta alle diverse
costanti cinetiche e coefficienti di fotolisi, per ogni composto.
Infatti in presenza per esempio di metano avvengono reazioni, formate anche da 80 stadi
che alterano l’equilibrio del ciclo.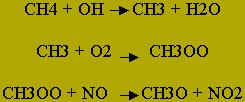 In questo caso si
viene a formare un composto in grado di ossidare l’ossido di azoto a biossido.
In questo caso si
viene a formare un composto in grado di ossidare l’ossido di azoto a biossido.
Questo ha due effetti egualmente dannosi:
a)fa aumentare la concentrazione di biossido di azoto, molto più dannoso
dell’ossido;
b)sottrae appunto l’ossido di azoto al suo ossidante naturale, l’ozono,
facendone aumentare la concentrazione.
Questa serie di processi è soltanto una piccola e semplificata parte di quello che viene
chiamato smog fotochimico.